Base experimental de la teoría atómica
Teorías atómicas
La teoría atómica de Dalton.
John Dalton (1766-1844). Químico y físico británico. Creó una
importante teoría atómica de la materia. En 1803 formuló la ley
que lleva su nombre y que resume las leyes cuantitativas de la
química (ley de la conservación de la masa, realizada por
Lavoisier; ley de las proporciones definidas, realizada por Louis
Proust; ley de las proporciones múltiples, realizada por él mismo). Su teoría se
puede resumir en:
1.- Los elementos químicos están formados por partículas muy pequeñas e
indivisibles llamadas átomos.
2.- Todos los átomos de un elemento químico dado son idénticos en su masa y
demás propiedades.
3.- Los átomos de diferentes elementos químicos son distintos, en particular sus
masas son diferentes.
4.- Los átomos son indestructibles y retienen su identidad en los cambios
químicos.
5.- Los compuestos se forman cuando átomos de diferentes elementos se
combinan entre sí, en una relación de números enteros sencilla, formando
entidades definidas (hoy llamadas moléculas).
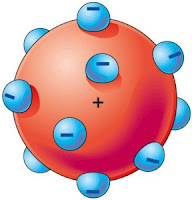
El modelo atómico de Thomsompson.
Thomson, sir Joseph john (1856-1940). Físico británico. Según el
modelo de Thomson el átomo consistía en una esfera uniforme
de materia cargada positivamente en la que se hallaban
incrustados los electrones de un modo parecido a como lo están
las semillas en una sandía. Este sencillo modelo explicaba el
hecho de que la materia fuese eléctricamente neutra, pues en los
átomos de Thomson la carga positiva era neutralizada por la
negativa. Además los electrones podrían ser arrancados de la esfera si la energía
en juego era suficientemente importante como sucedía en los tubos de descarga.
J. J. Thomson demostró en 1897 que estos rayos se desviaban también en un
campo eléctrico y eran atraídos por el polo positivo, lo que probaba que eran
cargas eléctricas negativas. Calculó también la relación entre la carga y la masa
de estas partículas
Para este cálculo realizó un experimento: hizo pasar un haz de rayos catódicos
por un campo eléctrico y uno magnético.
Cada uno de estos campos, actuando aisladamente, desviaba el haz de rayos en
sentidos opuestos. Si se dejaba fijo el campo eléctrico, el campo magnético podía
variarse hasta conseguir que el haz de rayos siguiera la trayectoria horizontal
original; en este momento las fuerzas eléctricas y magnética eran iguales y, por
ser de sentido contrario se anulaban.
El segundo paso consistía en eliminar el campo magnético y medir la desviación
sufrida por el haz debido al campo eléctrico. Resulta que los rayos catódicos
tienen una relación carga a masa más de 1.000 veces superior a la de cualquier
ion.
Esta constatación llevó a Thomson a suponer que las partículas que forman los
rayos catódicos no eran átomos cargados sino fragmentos de átomos, es decir,
partículas subatómicas a las que llamó electrones.
Las placas se colocan dentro de un tubo de vidrio cerrado, al que se le extrae el
aire, y se introduce un gas a presión reducida.
El modelo de Rutherford.
Sir Ernest Rutherford (1871-1937), famoso hombre de ciencia inglés
que obtuvo el premio Nobel de química en 1919, realizó en 1911
una experiencia que supuso en paso adelante muy importante en el
conocimiento del átomo.
La experiencia de Rutherford consistió en bombardear con
partículas alfa una finísima lámina de oro. Las partículas alfa atravesaban la
lámina de oro y eran recogidas sobre una pantalla de sulfuro de cinc.
La importancia del experimento estuvo en que mientras la mayoría de partículas
atravesaban la lámina sin desviarse o siendo desviadas solamente en pequeños
ángulos, unas cuantas partículas eran dispersadas a ángulos grandes hasta 180º.
El hecho de que sólo unas pocas radiaciones sufriesen desviaciones hizo suponer
que las cargas positivas que las desviaban estaban concentradas dentro de los
átomos ocupando un espacio muy pequeño en comparación a todo el tamaño
atómico; esta parte del átomo con electricidad positiva fue llamado núcleo.
Rutherford poseía información sobre el tamaño, masa y carga del núcleo, pero no
tenía información alguna acerca de la distribución o posición de los electrones.
En el modelo de Rutherford, los electrones se movían alrededor del núcleo como
los planetas alrededor del sol. Los electrones no caían en el núcleo, ya que la
fuerza de atracción electrostática era contrarrestada por la tendencia del electrón a
continuar moviéndose en línea recta. Este modelo fue satisfactorio hasta que se
observó que estaba en contradicción con una información ya conocida en aquel
momento: de acuerdo con las leyes del electromagnetismo, un electrón o todo
objeto eléctricamente cargado que es acelerado o cuya dirección lineal es
modificada, emite o absorbe radiación electromagnética.
El modelo atómico de Bhor.
Niels Bohr (1885-1962 fue un físico danés que aplicó por primera
vez la hipótesis cuántica a la estructura atómica, a la vez que buscó
una explicación a los espectros discontinuos de la luz emitida por los
elementos gaseosos. Todo ello llevó a formular un nuevo modelo de
la estructura electrónica de los átomos que superaba las dificultades
del átomo de Rutherford.
1.- El electrón tenía ciertos estados definidos estacionarios de movimiento (niveles
de energía) que le eran permitidos; cada uno de estos estados estacionarios tenía
una energía fija y definida.
2.- Cuando un electrón estaba en uno de estos estados no irradiaba pero cuando
cambiaba de estado absorbía o desprendía energía.
3.- En cualquiera de estos estados, el electrón se movía siguiendo una órbita
circular alrededor del núcleo.
4.- Los estados de movimiento electrónico permitidos eran aquellos en los cuales
el momento angular del electrón (m · v · r ) era un múltiplo entero de h/2 · 3.14.
TEORÍA ATÓMICA DE SOMMERFELD
(1916)
Este científico introdujo dos
modificaciones básicas:
Órbitas casi-elípticas para los electrones y velocidades relativistas. Sus postulados
fueron los siguientes:
Los electrones se mueven alrededor del núcleo, en órbitas circulares o elípticas.
A partir del segundo nivel energético existen dos o más subniveles en el mismo
nivel.
El electrón es una corriente eléctrica minúscula.
La contribución de este modelo fue más que todo para la física teórica, ya que
podría decirse que fue complemento del modelo de Bohr con modificaciones
relativistas.
Sommerfeld descubrió que en algunos átomos, los electrones lograban alcanzar
velocidades muy cercanas a la velocidad de la luz por lo que optó por basar su
análisis en la teoría relativista. Esta decisión estuvo llena de intrigas y polémicas
en la época, debido a que la teoría de la relatividad aún no había sido aceptada en
la comunidad científica.
TEORÍA ATÓMICA DE SCHRODINGER (1924)
La principal contribución de este modelo fue desde el punto de vista
cuántico, el mismo propone que los electrones a través del núcleo se
comportan como una onda con niveles de energía de acuerdo a sus orbitales. Por
lo tanto pudo modelar cada electrón como una función de onda, hecho que
contribuyo desde el punto de vista matemático al cálculo de energía.
Los electrones son ondas de materia que se distribuyen en el espacio según la
función de ondas (Ψ):
Los electrones se distribuyen en orbitales que son regiones del espacio con una
alta probabilidad de encontrar un electrón. Dicha probabilidad viene determinada
por el cuadrado de la función de ondas (Ψ2).
Se tienen en cuenta los siguientes números cuánticos:
Número cuántico principal (n = 1, 2, 3...): indica el nivel energético del electrón y
su distancia al núcleo
Número cuántico secundario o Azimutal (l = 0, 1, 2,..., n-1): subniveles energéticos
para cada n.
Número cuántico magnético (m): orientación del orbital ante campos magnéticos
externos. Valores entre -l y + l
Número de espín (s): sentido del giro del electrón. Valores 1/2 y - 1/2
Orbitales del modelo atómico de Schrödinger
En un átomo no puede haber electrones con los cuatro números cuánticos iguales
La configuración electrónica del modelo atómico de Schrödinger explica las
propiedades periódicas de los átomos y los enlaces que forman.
TEORÍA ATÓMICA DE DIRAC (1928)
En 1927, Erwin Schrödinger, establece una ecuación matemática
que al ser resuelta permite obtener una función de onda (psi
cuadrado) llamada orbital. Esta describe probabilísticamente el
comportamiento de un electrón en el átomo. Esta función es
llamada densidad electrónica e indica la probabilidad de encontrar
un electrón cerca del núcleo. La probabilidad es mayor mientras
más cercana al núcleo y menor si nos alejamos del núcleo. Con esta teoría de
Schrödinger queda establecido que los electrones no giran en órbitas alrededor
del núcleo como el modelo de Bohr, sino en volúmenes alrededor del núcleo.
en las ecuaciones de Dirac y Pascual. Jordán (1902-1980) aparece el cuarto
parámetro con característica cuántica, denominado S, además de los ya
conocidos N, L y M. Da una descripción de las partículas elementales de espín ½,
como el electrón, y es completamente consistente con los principios de la
mecánica cuántica y de la teoría de la relatividad especial. Además de dar cuenta
del espín, la ecuación predice la existencia de antimateria., El modelo de Dirac-
Jordan, también se llama "Modelo Cuántico"






Comentarios
Publicar un comentario